Разделы сайта
- Главная
- Исследования и анализ современных технологий
- IP-телефония
- Антенно-фидерные устройства
- Виртуальное построение рабочей локальной сети
- Влияние электромагнитного поля на подземную проволочную антенну
- Микрополосковая антенная решетка
- Система экологического мониторинга вредных газовых выбросов
- Организация процесса производства цифрового телевиденья
Физические свойства кристалла
Рис. 2.1. Структура элементарной ячейки кристаллов типа флюорита
В качестве активных материалов оптических квантовых генераторов (ОКГ) в настоящее время применяются следующие фториды щелочноземельных материалов: CaF2 (Nd3+, Ho3+, Tm3+) и т.д. Эти фториды имеют кубическую структуру типа флюорита С1. Пространственная группа O5h - Fm3m, элементарная ячейка содержит четыре молекулы. Катионы координированы восьмью ионами фтора, расположенными в вершинах куба; ионы фтора - четырьмя катионами, образующими тетраэдр (рис. 2.1). Параметры кристаллической структуры и ионные радиусы флюорита даны в табл. 2.2.
Таблица 2.2
|
Соединение |
Ионный радиус, Å |
Период элементарной ячейки, Å |
Расстояние между ионами |
|
CaF 2 |
1,04 |
5,45 |
2,36 |
Ионы редкоземельных элементов легко входят в решетку фтористого кальция благодаря хорошему совпадению значений ионных радиусов. Ионный радиус Са2+ в CaF2 равен 1,04 Å, а ионные радиусы редкоземельных элементов от Ce до Lu составляют 1,07 - 0,85 Å.
Введение трехвалентных ионов Ln3+ в решетку флюорита вместо двухвалентных ионов кальция связано с необходимостью компенсации заряда в кристалле. Эта компенсация может быть выполнена одним из трех способов:
) Один ион Tm3+ замещает один ион Са2+, а в соседнюю ячейку кубической решетки вводится дополнительный ион F-;
) Один ион Tm3+ замещает один ион Са2+, а второй ион Са2+ замещается ионом какого-либо одновалентного металла M+;
) Два иона Tm3+ замещают три иона Са2.
Однако все эти способы приводят к искажению симметрии структуры и появлению дополнительных центров окраски и люминесценции. В кристаллической решетке флюорита возможны несколько типов оптических центров Ln3+, различающихся структурой. Это обусловлено многообразием элементарных точечных дефектов эффективных электрических зарядов. Различные комбинации дефектов с ионами Tm3+ и обуславливают наблюдающееся на практике многообразие оптических центров. В кристаллической решетке флюорита возможны несколько типов оптических центров Ln3+, различающихся структурой. Это обусловлено многообразием элементарных точечных дефектов эффективных электрических зарядов. Различные комбинации дефектов с ионами Ln3+ и обуславливают наблюдающееся на практике многообразие оптических центров. Структуры некоторых центров Ln3+ в кристаллах типа флюорита показаны на рис. 2.2. Возможности образования центров различной структуры обусловливает сильная изменчивость оптических свойств кристаллов флюорита с Ln3+ при небольших изменениях процессов синтеза и выращивания кристаллов или концентрации активатора и других примесей. К этим другим примесям относятся анионные примеси типа кислорода. Влияние кислорода на спектры люминесценции очень заметно: изменяется не только положение, но и число линий. Кислород легко входит в решетку флюорита, изоморфно замещая ион фтора, так как ионные радиусы их близки (F-=1,33, O2-=1,36Å).
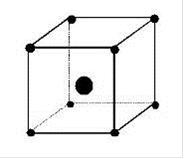
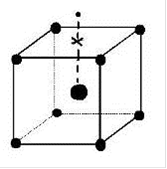
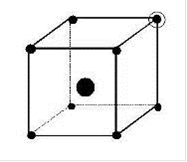
Рис. 2.2. Структуры оптических центров Ln3+ в кристаллах: кубический центр; тетрагональный; тригональный; ромбический (слева направо)
При этом появляется новая ось симметрии. Такие центры участвуют в генерации. На оптические свойства кристаллов флюорита сильное влияние оказывает облучение жестким рентгеновским или γ - излучением. При этом ионы Ln3+ частично восстанавливаются в Ln2+, электромагнитное поле решетки изменяется; это обусловливает перестройку структур оптических центров оставшихся ионов Ln3+. Как правило, сложные центры (например ромбические) исчезают. Однако после обжига этих кристаллов при 300 - 400˚С первоначальные спектры их полностью восстанавливаются.
Самое читаемое:
Анализ систем автоматизированного управления численными методами
Бурное развитие новейшей техники и всё большее внедрение современных
разделов математики в инженерные исследования неизмеримо повысили требования к
математической подготовке инженеров и научных работников, занимающихся
прикладными вопросами. В настоящее время, требуется знание многих разделов
современной математики и в первую очеред ...